超氧阴离子自由基电化学分析的新进展
1引言
作为新陈代谢的活性中间体,正常状态下自由基在生物体中保持相对稳定的动态平衡。细胞自身的细胞色素c(Cytochromec,Cyt.c)、超氧化物歧化酶(Superoxidedismutase,SOD)等具有抗氧化能力,可以将自由基转化为无害物质进行自我修复,这一系列的过程对细胞增殖、凋亡、损伤具有重要的影响,并在细胞信号转导过程中起着十分重要的作用。当细胞受到外界剌激或发生病变过程中会产生过量O2'_自由基,使得细胞产生氧化应激,引起癌症、神经性疾病、帕金森病等生理病变,从而对细胞的生理和病理功能产生重要的影响。因此,检测生物体中O〗_自由基的浓度具有十分重要的现实意义。
然而,因为自由基具有氧化活性高、体内浓度低、寿命短等特点,所以需要发展原位、实时、活体的自由基检测方法。电化学方法具有操作简单、易微型化、灵敏度高、易于原位、实时、在体检测等优点而备受关注,其中,基于酶传感器的电化学分析方法最为引人注目。
2溶液/电极界面的设计及酶的直接电子传递
2.1溶液/电极界面的设计
针对自由基的电化学分析,对溶液/电极界面进行设计以改善和提高电极的分析性能是一个极其关键的问题^2?16。酶自身体积较大,而活性中心通常都深埋在其内部,从而加大了活性中心到电极表面的电子传递距离,不利于实现直接电子传递。第二代酶传感器采用氧化还原电子媒介体在酶的氧化还原活性中心与电极之间传递电子,但存在媒介体的流失和干扰大的缺陷,给O〗_自由基的准确测定带来干扰,从而极大限制了其实际应用。第三代酶传感器的开发使这个领域向前迈进了一大步。通过界面设计优化,利用酶的直接电子传递机理克服了原先的不足,能够实现细胞或生物体中自由基的直接检测。界面设计优化是人为地设计电极表面微结构和其界面反应,通过将酶固定在电极表面上,使暴露的电活性中心更接近电极表面,实现酶与电极之间快速的电子传递,达到预期检测的目标。2.1.1分子设计分子自组装是对固体表面进行修饰最为有效的手段之一。高度有序、结构可控、定向密集的稳定分子层为保持酶蛋白质的天然结构和构象提供理想的微环境。同时,单分子作为加快电子传递的促进剂,可以用于探索电极表面分子微结构和宏观电化学响应之间的关系。巯基化物在金属表面自组装是目前研究得最广泛、最深入的一类物质。其自组装膜有序性强,不易聚合,条件控制容易等优点扩展其在传感方面研究和应用的范围。Tian等^在金电极表面自组装一层巯基半胱氨酸单分子膜来考察溶液中SOD的电化学活性,同时以裸金电极作为对比,实验结果证实SOD能够固定于分子修饰电极的表面上,使得电极反应更容易实现,这可能由于半胱氨酸在界面自发形成的一种热力学稳定分子层,更有利于实现SOD“软着陆”。随后,他们又将3种SOD(Cu,Zn-SOD,Fe-SOD和Mn-SOD)分别固定在巯基半胱氨酸修饰的金电极界面上,首次同时实现3种SOD的直接电子传递;巯基半胱氨酸作为促进剂加快电子的传递。通过分子设计在界面上自组装单分子体系考察电子转移过程,为更深层次的分子设计和功能组装反馈信息M。
此外,作为一种常用的选择性结合组氨酸标记蛋白质的方式,次氮基三乙酸/组氨酸(NTA/HT)技术成为组氨酸结合最成功的模版。其将蛋白质定向有序固定在电极表面上,并加快电子传递。Joln_等㈣利用该通用模版技术成功将蛋白质固定在金电极表面上,通过大环效应使NTA衍生物的三氮杂环与金属离子稳定反应,使得该体系具有更高的稳定性。Wang等^1首次利用NTA/HT技术将SOD修饰到电极表面上,极大提高了电子传递速率,电子传递常数为(24±1.1)S!1;同时,实现了SOD的直接电化学,并进一步应用于鼠脑在局部缺血和再灌注的过程中自由基浓度变化的检测。
在简单的蛋白质^分子仿生体系中,分子设计在提高传感器检测底物的灵敏度、控制活性中心与电极表面距离、加快长程电子转移等电分析化学的应用和理论方面发挥了重要作用。
2.1.2纳米材料利用酶的特异性检测O2'_自由基时,往往受限于酶负载量过少或缺乏电子传递导体从而致使电信号过小或者电子传递过慢,影响传感器的整体分析性能。纳米材料是材料学中最基础、最活跃的组成部分。不同于体材料和单个分子,纳米材料具有小尺寸效应、表面效应和量子尺寸效应等独特的物理化学性质,特别是良好的生物相容性和稳定性,可作为负载酶的良好基质,在传感领域获得广泛的应用。
Brown等M将直径12nm单层金溶胶颗粒修饰二氧化锡电极,实现了溶液中Cyt.c的直接、可逆电化学,且无需任何预处理步骤。金溶胶颗粒可看作是空间紧密而独立的微电极组合体。但随着纳米颗粒的聚集,Cyt.c的电化学变的准可逆或者不可逆,表明纳米金属尺寸和形貌在实现蛋白质的直接电子传递中也起到极其关键的作用。Zhu等122首次利用1,5或二硫醇交替连接Au、Ag胶体制备多层Au/Ag膜,在温和条件下通过氯金酸溶液去除成孔物质纳米Ag,通过层层自组装技术在氧化铟锡(ITO)电极表面制备了纳米多孔金膜。Cyt.c保持其生物催化活性,电子转移速率为3.9s!1。同时,该第三代传感器具有良好的选择性和稳定性,其检出限达到6.3x106mol/L,线性范围是1.0x105~1.2x102mol/L。
Bi等M通过将多壁碳纳米管修饰玻碳电极上实现了SOD的固定。多壁碳纳米管表面的晶格缺陷提供了较高的局部电子密度,有利于电子在酶蛋白和碳纳米管之间传递;同时,特殊结构的碳纳米管可以作为“分子导线”,加快电子传递到SOD的活性中心,以上两方面因素致使SOD在电极表面上实现直接电子传递。
Deng等M利用蒸汽方法直接在预处理ITO表面沉积上一层花状ZnO纳米材料,设计出新型纳米材料界面,增大了基底的比表面积和导电性。同时,生物相容性保持了SOD的高生物催化活性,结合ZnO作为“纳米导线”加快电子的传递作用,实现了SOD的直接电子传递,构筑了第三代生物传感器,异相电子传递常数可达(10.4±1.8)s!l。Zhu等123将Cyt.c固定在SiO:纳米材料修饰的玻碳电极表面上,实现了Cyt.c的直接电化学。实验数据证实Cyt.c的直接电子传递及微环境的改变与SiOi双功能结构的空间几何构象有关。该模型能够定性的解释纳米材料的尺寸和浓度对氧化还原蛋白的直接电子传递的影响,同时也为广泛应用无机纳米材料来促进电子传递提供一种新思路。
随着纳米技术的不断发展和壮大,各种纳米材料在传感器领域的应用日趋广泛。纳米材料所具有的高比表面积、高活性、特殊物理性质及生物相容等特性使其成为应用于传感方面最有前途的材料之一。2.2基于酶直接电子传递的传感器
直接电子传递是蛋白质分子与电极表面在没有任何媒介和试剂的情况下直接进行电荷交换,这样有利于电子传递效率的提高,更能反映生物体系内的氧化还原系统,为揭示生物体内电子传递的机理奠定了基础。但是酶蛋白的活性中心通常是深埋在其内部,当其固定在裸电极表面时,没有合适的界面微
环境来实现其直接电子传递,致使阻碍其在活体检测方面的实际应用。通过界面设计使修饰电极可以建立理想的接触界面,暴露酶的电活性中心,实现酶与电极之间快速的直接电子传递,并利用其对自由基的选择性达到预期的检测目的,对于预防和治疗疾病以及抗氧化药物的研发都具有现实意义。
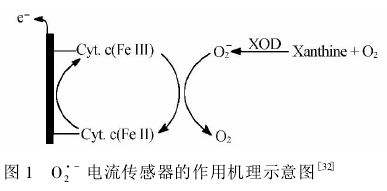
2.2.1基于Cyt.c的传感器Cyt.c是一种存在于线粒体内膜外侧的金属蛋白分子,是呼吸链中一个重要的电子载体。通过血红素辅基中心铁离子价态的变化来传递电子,在细胞呼吸链中具有举足轻重的作用。研究其在电极上的电子传递及与O2'_自由基的生物作用,对于了解生命体内的能量转化和物质代谢具有重要的意义。因此,探索实现Cyt.c与电极表面之间的直接电子传递成为电分析化学研究的方向之一。 Cooper等将巯基半胱氨酸自组装到裸金电极表面,通过碳二亚胺缩合反应固定Cyt.c,考察了yt.c与电极之间的电子传递情况,结果显示Cyt.c在电极表面实现直接电子传递;其表观电位为2mV(),表明此传感器具有潜在实际应用的可行性。Cooper等M采用电化学分析方法检测黄嘌昤/黄嘌昤氧化酶体系酶化反应产生的自由基,其原理如图1所示。酶化反应产生O〗_自由基还原Cyt.c,自身被氧化成Oi;同时还原态的Cyt.c在电极表面正电位下迅速被氧化为氧化态。基于此反应机理,他们实现了嗜中性粒细胞中应激产生的02’_自由基的动态检测,且引起的电流响应速率与02"自由基的产生速率成线性关系。-传感器的灵敏度取决于负载活性酶的数量以及酶与自由基的反应速率。Wegrich等63利用定点诱变技术在Cyt.c活性位点附近引进带正电荷的赖氨酸,考察其在巯基分子修饰的金电极上的分析性能。实验数据表明诱变重组的Cyt.c均具有氧化还原图10厂电流传感器的作用机理示意图电活性,能够实现直接电化学,并且与O2’_自由基的Fig.1Mechanismofoperationofamperometric反应速率显著加快。基于诱变Cyt.c构筑的电化学生sensor物传感器在灵敏度和稳定性上都有不同程度的提 高。纳米材料的不断发展为电极界面设计提供了新的契机,其巨大的比表面积和良好的生物相容性,既 能增大酶的负载量,又能较好的保持酶蛋白的高催化活性,同时作为良好导体加快电子的传递。Rahimi 等M将多层碳纳米管/室温离子液体的纳米复合材料与Cyt.c混匀后,直接滴涂到玻碳电极表面上,简单有效地制备了O〗_第三代生物传感器。首先,多层碳纳米管作为电子促进剂,加快Cyt.c和电极之间的电子传递;其次,室温离子液体保持了Cyt.c的空间构象结构和生物催化活性,二者协同提高了传感器的 灵敏度、响应时间、检测限等分析性能。正如人们所期望的,基于Cyt.c的O〗_传感器可避免抗坏血酸、尿酸的干扰,能够在低电位下检测。然而,作为过氧化物酶的本质特点,Cyt.c同样能够还原来自酶化反应产生和体内共存的&O2,受其干扰。虽然Gobi等M报道可以通过设计电极来控制Cyt.c的过氧化酶活性,但Cyt.c不是O〗-的特异性酶,这极大限制了其在复杂生物体系中的选择性检测的作用。众所周知,SOD可高活性和选择性地将O〗-歧化为O:和H2O2M,从而完成O〗-高选择性测定。因此,采用SOD替代Cyt.c来构筑高灵敏度和高选择性的O〗_生物传感器越来越受到业内人士的普遍关注。
2.2.2基于SOD与仿生SOD的O「传感器SOD是广泛分布于生物体内重要的抗氧化酶,也是生物体内清除自由基的首要物质。作为一种金属蛋白酶,常见的几种不同金属中心SOD是Cu,Zn-SOD,n-SOD,Fe-SOD和Ni-SOD,它们都能将O;-自由基有效的歧化为%。2和。2保护机体不受毒性的侵害。但其电活性中心都包埋于蛋白质深处,致使SOD与电极表面的直接电子传递难以实现。
因此,实现SOD与电极之间的直接电子传递对第三代O2’_生物传感器的构筑以及实际应用的发展具有现实意义。
Ohsaka等M首次将Cu,Zn-SOD修饰在半胱氨酸自组装修饰的金电极表面上构筑了第三代传感器。实验结果表明,自组装的半胱氨酸分子可作为SOD电极反应的促进剂。结合传感器高灵敏度、高选择性和快速响应的良好分析性能,实现对酶化反应产生O^自由基的检测,这一工作是利用SOD直接电化学实现O;_自由基检测的一个巨大突破。Ohsaka课题组M首次发现O;_自由基在SOD电极上能够同时氧化和还原,并进行对比实验证实了可以在氧化和还原电压双向检测自由基,这为实现溶液中自由基的分析检测提供了第一手资料,同时为实现持久和可靠的检测生物体系里的O;-自由基奠定了基础。接着,Tian等^首次在半胱氨酸膜修饰的电极上同时实现3种活性中心SOD(Cu,Zn-SOD,Fe-SOD和Mn-SOD)的直接电子传递。如图2所示,通过活性中心的氧化还原循环,SODs能够催化还原成H2O2和氧化成O2,使得阳极和阴极上的电流响应明显增大,这说明SOD对O;-具有双功能电催化活性。结合SOD快速电子传递的特性,该传感器为双向实现O^电化学检测的提供了一条可行性路线。
Ge等M将Cu,Zn-SOD和Fe-SOD固定在巯基半胱氨酸修饰的裸金电极表面上,研究其动力学和吸附过程,结果表明通过不同动能学过程均能结合到电极表面上。
在实际应用检测中,高灵敏、高选择性的检测方法越来越显示出其重要性。纳米技术的发展为高灵敏电化学分析方法的发展提供了机遇。例如,纳米材料在生物分析检测中得到了广泛应用,已有多种信号放大方法用于高灵敏电化学分析方法的构建。
如图3所示,Tian课题组[43首次在锥状、棒状和球状3种不同形貌的纳米金表面上同时实现了SOD的直接电化学。热力学和动力学分析表明SOD在不同界面上的电子转移速度,与纳米金的形貌有关;同时,
良好的生物相容性让纳米金表面的SOD保持了其自身的生物催化活性,可用来构建既可在氧化电位又可在还原电位下进行0厂自由基检测的生物传感器。
无需其它步骤,结合良好的分析性能大大增加了其应用于实现生物体内O^测定的可行性。
综上所述,分析检测都是在体外分析体系中通过外来不断加入O2'_自由基进行电分析,与体内的复杂生物环境截然不同。因此我们很有必要对体内O;-自由基进行准确的分析检测,以便更好的深入理解O^自由基在生理和病理上中所发挥的作用。
3细胞释放检测
在细胞水平上,当细胞受到外界剌激或者生理病变过程中会产生过量自由基,从而对细胞生理功能产生重要影响,进而引起生理病变。因此,构筑适于检测细胞内O2'_自由基的传感器,原位、实时地检测自由基浓度的变化,对疾病预防与治疗的途径具有重要的生理及病理意义。
Tanaka等[44利用碳纤维修饰电极检测由免疫球蛋白G和卟啉醇肉豆蔻酸乙酸酯剌激单中性白细胞产生O^自由基的氧化电流。实验证明自由基会在剌激1min后产生,5min达到最大值,20min后消失,这种方法获得的电流4寸间关系与传统方法获得的结果一致。随后,Tanaka课题组[45设计了一种检测由单个噬菌细胞释放自由基的电流方法,其灵敏度高达到fA级。
在实际样品检测时,天然酶的空间结构和构象变化容易致使其丧失催化活性,成为制约它们实际应用瓶颈。为了避免这些缺陷,基于活性位点■铜、铁和锰设计的低分子量、具有SOD生物活性的仿生酶研究已陆续报道[4649]。Cabelli等^研究了锰磷酸盐作为仿生SOD在有机活体内的抗氧化机理。为了证明结果的可靠性,他们采用两种不同方法:脉冲辐射法和Co~60i辐射法产生自由基。实验证明Mn2+与O「自由基反应生成暂态的MnO:+,然后MnO:+快速歧化生成O:和^O:。

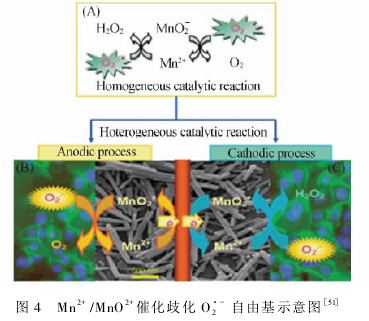
Tian课题组利用M%(PO4)2具有仿生SOD的生物特性,在高导电纳米针状TiOi膜上构筑了一个具有选择性高和稳定性好的第三代O〗_生物传感器,提供了一种方便、快速原位直接检测贴壁生长在修饰膜表面的正常人胚肾细胞HEK293T和CHO癌细胞释放的O〗_自由基的电化学分析新方法。检测原理如图4所示,在M%(PO4)2仿生酶的催化作用下发生歧化反应的过程中,将Or分别转化成Oi和&O2(如图4A)。此过程可看成是分别在两个电极上独立进行的两个反应。一方面,在阳极反应中图(4B),电解液中的被MnOi+的氧化生成O2,同时MnOi+被还原成Mn2+。而生成的Mn2+能够在电极上失去电子,重新被氧化成MnO2+。另一方面,在阴极反应中(图4C),O;-氧化Mn2+生成MnO2+,而生成的MnO2+在电极表面得到电子被还原成Mn2+。因此,在O〗-存在的情况下,通过Mn2+修饰电极上的氧化或还原电流检测O2'_。因此,通过两极上氧化或还原电流信号的变化,即可实现对O2’_的检测。电化学信号表明此生物传感器可以实现细胞应激反应产生0厂自由基的可逆响应,暗示02'_自由基可作为_种癌症生物标记物,为生理和病理方面的研究提供了基础。
基于SOD生物仿生酶(PO4)2,Zhou等开发了一种可靠和持久原位实时检测O-自由基的方法。Mn2+通过离子交换作用进入zeolite~ZSM-5的纳米结构中,进一步被聚二烯丙基二甲基氯铵化覆盖固定到电极表面上。沸石的纳米微结构加快了Mn2+的直接电子传递,其表观电位是(561±6)mV(AgCl),位于O2'-/O2和O2'-/H2O2动力学电位内,可以将O〗_歧化为Oi和%O2。利用分子筛较好的生物相容性和细胞黏附性,让细胞贴壁生长,
可靠、持久的原位实时测定了细胞释放出来的O‘-自由基浓度,实现从理论到实践应用的转变。
作为细胞信号的传导分子,自由基与金属离子密切关系,包括Ca2+通道、K+通道、Na+通道等。
Tian课题组153基于Mn^TPAA(Mn-tris2-(2-pyridylmethyl)aminoethyl]amine)仿生酶构筑了O;生物传感器,具有高的稳定性和良好的重现性。以Hela细胞为模型,他们进一步研究了细胞释放O〗_自由基与细胞内Ca2+之间的依存关系。如图5所示,在无抑制剂时,加入Ang□后荧光强度明显增强,说明Angn剌激细胞产生的O「促使细胞内Ca2+的释放,Ca2+与Fluo4-AM结合,从而使荧光增强。然而,在实验前先用NADPH氧化酶抑制剂Apo或阴离子通道阻滞剂DIDS处理10min,再进行的相同实验时,AngH剌激细胞前后荧光强度没有明显变化。这说明Apo抑制细胞外O〗_的产生而影响荧光强度的增加,DIDS阻止细胞外O〗_进入细胞而抑制细胞Ca2+浓度的增大。这一研究对认识自由基信号的传导与其它生理和病理的关系提供了一种新思路。
4活体电化学分析
电化学分析方法虽具有高灵敏性、原位、实时在线检测等优点,适于活体内o2'_自由基的分析和检测,但目前这方面鲜有文献报道。
对于植物体内0厂自由基的检测,Deng等M基于半导体ZnO纳米材料成功构筑了第三代生物传
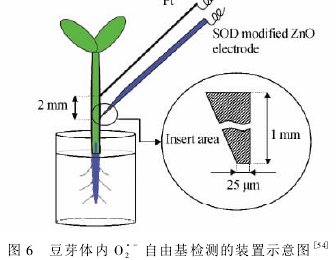
感器,实现了豆芽体内O^的检测。如图6所示,活体实验采用双电极体系,ZnO/SOD微电极作为工作电极,铂丝作为对电极。ZnO/SOD微电极的制备步骤如下:首先,ITO导电玻璃切割成剌状;然后,将ZnO纳米材料电沉积到导电玻璃表面上,并进一步负载Cu,Zn-SOD。结果表明,通过一步、无模版的电沉积得到新型六角形ZnO纳米材料,可实现了SOD的直接电子传递;再结合SOD对O^自由基的催化歧化,实现了豆芽体内O^自由基的在线检测。该项研究不仅为酶蛋白在纳米结构半导体膜上构筑第三代生物传感器建立了一个模型,也为研究生物体内O2’-作用机理开启了一扇窗口,可以更深入的理解O;-自由基在生理学和病理学中的作用。
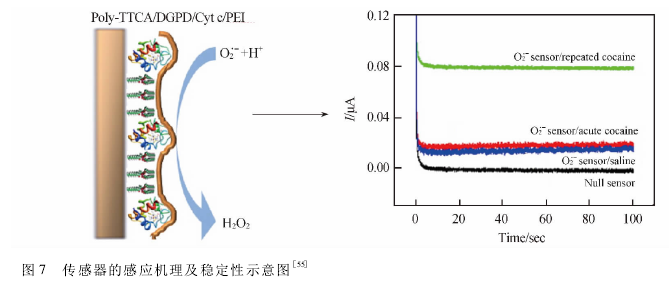
利用TTCA(5,2:5,2-terthiophene-3-carboxylicacid)聚合物膜依次共价键固定DGPD(1,2-Dipalmi-toylsn~glycero-3~phosphoethanolamine^i~dodecanylamine)和Cyt.c,Rahman等1551制备了一种高稳定、高灵敏的体内检测O2_的第三代传感器。他们通过持续不断的往鼠脑注入可卡因溶液剌激产生O2_,并利用该传感器对细胞外的o2’-进行检测。如图1所示,该传感器在盐水、急性和重复注射可卡因不同实验条件下产生了不同程度的电流响应,其中重复注射可卡因操作下传感器的灵敏度最高。-0.31V的低电位结合聚合物膜的屏蔽可使传感器在测定0厂自由基时避免抗坏血酸、尿酸、过氧化氢、氧气等干扰,从而保证此微型传感器植入鼠脑成功测定体内02'-自由基的浓度,并且能够实现动态检测体内02-自由基浓度随可卡因不断急性注入的变化。该微型生物传感器可以作为监测兴奋剂药物暴露引起细胞外0厂自由基浓度变化的一种有效工具。
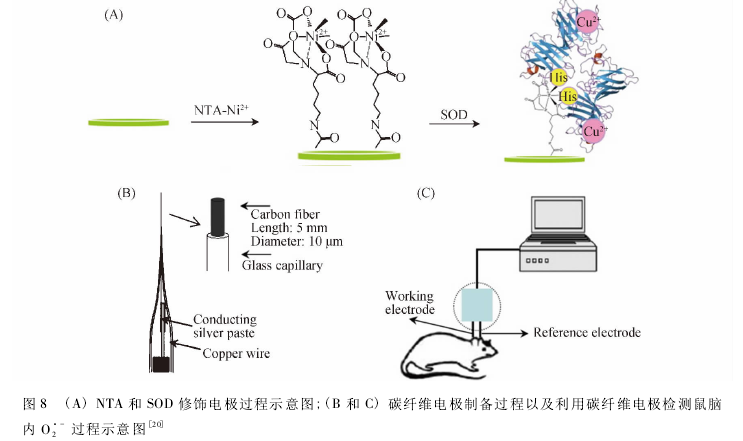
近来,Tian等63提出了一种植入型微碳纤维电极直接实现活体内0厂自由基检测的新思路。此碳纤维基底上固定的SOD在测定0厂上拥有显著的高选择性和良好的稳定性;同时背景电流的减小使得碳纤维微电极在高灵敏测定生物体内0厂自由基占有优势。随后,Tian课题组M首次利用NTA/HT技术实现了SOD在NTA修饰电极上的直接电化学,极大提高了电子传递。整个传感器的制备过程如图8(A和B)所示。结合传感器的高灵敏度、高稳定性的分析性能以及碳纤维电极生物相容性和可微型化特点,该课题组成功实现鼠脑在缺血再灌注过程中0厂自由基浓度的变化检测(图8C)。该研究为体内活性氧的进一步研究提供了一种新思路,同时也为理解其在氧化应激和生理病理过程中的作用提供了独特的视角。
建立基于纳米材料与功能分子设计界面的02’-自由基检测新方法和适于活体检测的超微电极技图8(A)NTA和SOD修饰电极过程示意图;(B和C)碳纤维电极制备过程以及利用碳纤维电极检测鼠脑内02’_过程示意图
术,将为研究等活性氧在细胞信号转导中的作用,进而解析0厂自由基等活性氧在生命活动中的作用机理,治疗和预防与氧化应激等有关疾病,以及抗氧化物新药的研制与开发等提供一种新的研究思路。
5总结与展望
综上所述,基于SOD的0厂自由基电化学分析方法具有灵敏性高、选择性好、易于实时、在体检测等优点。同时,蛋白质在电极界面的电化学行为与其在生物体内环境的电子传递行为有类似之处,可以利用具有仿生界面特点的传感器来研究生物体系的电子传递情况。虽然目前0厂自由基的电分析方法取得了长足的进步,但实际生理条件下0厂自由基产生、消亡的动力学研究尚欠缺,意味着对0厂自由基在生命活动中的作用和机理仍处于探索研究阶段,还需进一步与生命科学和医学紧密结合,在生命体系中进行深入的探索。此外,通过设计制备新型纳米材料和合成新颖分子,可构筑生物相容性更佳、灵敏度更高、稳定性更好的0厂自由基传感器;在实际样品的测定中,通过将电极微型化、阵列化,可实现细胞内0厂自由基的定性、定量以及原位实时、在线、高通量的检测;将设备商品化,以及与计算机联用,实现连续、自动化分析检测,更适合临床和现场的检测分析,这预示电化学分析将在0厂传感器的未来进程中发挥着前所未有的作用。
下一篇:石墨烯量子点的制备
