丹参对非酒精性脂肪性肝炎大鼠肝组织NF-/cB、
随着饮食结构和生活习惯的改变,肥胖及代谢综合征的流行,非酒精性脂肪性肝炎(non-alcoholic steatcHepatitis,NASH)的发病率呈日渐升高趋势, 成为仅次于病毒性肝炎的第二大肝病,在某些地区甚至超过病毒性肝炎。目前西药疗效并不十分理 想,中医药在治疗NASH方面的疗效日益受到重 视。本研究通过观察丹参注射液对NASH大鼠肝 组织NF-kB、TNF-a表达的影响,探讨丹参防治 NASH的可能作用途径,为治疗NASH筛选有效 药物提供实验依据。
1材料与方法
1.1实验动物45只SD雄性大鼠购自中山大学动物实验中心大鼠于清洁动物室饲养,普通饲料喂养,自由饮水。
1. 2造模方法45只SD大鼠随机分为4组:正常组、模型组、 丹参治疗组和西药对照组,除正常组大鼠正常饮食 外,其余各组大鼠均采用高脂饲料喂养:普通鼠饲料 基础上加2%胆固醇和13%猪油,分笼饲养,自由摄 食与饮水,每日更换饲料和水1次,饲养16周。 NASH造模标准参照范建高等的方法[1]。
1. 3给药方法西药对照组每天予还原型谷光甘肽钠溶液, 10 ml/kg腹腔注射,丹参治疗组大鼠每天予丹参注 射液,m/kg腹腔注射(丹参治疗量及谷胱甘肽钠 治疗量均相当于成人用量的20倍),正常组和模型 组予等量生理盐水腹腔注射,连续16周。
1.4检测项目及方法
1.4. 1免疫组织化学检测肝组织TNF-a表达按 照SP免疫组织化学试剂盒说明书进行免疫组织化 学检测,用已知阳性片作为阳性对照,PBS缓冲液 取代一抗作为阴性对照。TNF-a蛋白阳性表达表 现为细胞质呈棕褐或棕黄色,选择多个具有代表性 的高倍视野,采用IPP软件计算平均光密度值。试 剂盒购自武汉博士德生物工程有限公司。
1. 4. 2 电泳迁移率改变分析检测大鼠肝组织NF- kB 活性参照核心试剂盒说明书,按下列顺序操 作:①提取并定量核蛋白探针标记纯化;^4%非 变性聚丙烯酰胺凝胶配制结合反应;©0. 5 X TBE电泳液,予恒压180 V电泳90 min;⑥剥离胶 片,电灯烤干,磷屏曝光20 h;⑦应用图像分析软件 BandScan 5. 0 对所形成的特异性产物条带计算积 分光密度分析,以丹参组与正常对照组的结合条带 的IA比值表示丹参治疗组的相对结合活性。试剂 盒购自上海碧云天生物技术公司。
1.5取材造模第16周末,各组大鼠禁食不禁水12 h,予 2%戊巴比妥钠麻醉后沿腹中线开腹,快速取出肝 脏,检测相关指标。
1.6统计学处理采用SPSS14 0软件进行统计学处理,计量资 料以无士s表示,P〈0. 05为差异有统计学意义。
2 结果
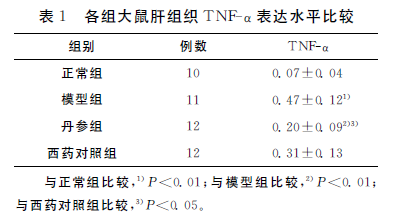
2. 1肝组织免疫组织化学TNF-a的表达TNF-a主要表达于细胞浆,着色为棕褐色或棕 黄色。正常肝组织中着色很淡,几乎不表达。模型 组TNF-a阳性表达较正常组明显增强(P〈0. 01), 与模型组比,丹参治疗组TNF-a表达明显减低(P〈0. 01)。见表 1。
2.2 EMSA检测各组肝组织NF-kB活性通过EMSA实验发现,模型组肝组织NF-kB 较正常组明显升高(P〈0. 01),丹参干预后肝组织 NF-kB明显降低(P〈0. 01)。见图1、2。

图2各组与正常组的NF-kB特异结合的条带IA比值
3 讨论
非酒精性脂肪性肝炎(NASH)是一种遗传-环境-代谢应激相关性肝病,其发病机制非常复杂,目前尚未完全明确。Day等提出的“二次打击”学说以脂质代谢异常、细胞因子、氧化应激、脂质过氧化被广泛接受[2-3]。中医学无NASH 这一病名,根据其症状及临床特点,将其归为“胁痛”、“积聚”、“痞满”、“痰证”、“湿阻”等范畴。该病最早记载于《难经》:“肝之积,名曰肥气。”故也称肥气病,指体内过多肥脂之气蓄积于肝脏。中医认为NASH 形成外因是嗜食肥甘厚味,内因是肝胆疏泄失常,脾失健运,导致气滞痰阻,久而成瘀,痰瘀互结而成。现代药理研究已经证实丹参具有促进脂质代谢,抗脂质过氧化、清除自由基、抑制氧化应激,减轻肝细胞变性坏死,促进肝细胞再生等作用。
NF-κB是一种前炎性递质基因核因子,通过调控基因转录来调控炎症反应、免疫应激反应、细胞黏附及凋亡,特别在表达炎症基因中占有枢纽性位置[7-8]。TNF-α是NASH 发病的独立危险因素,在单纯性脂肪肝转化为NASH 过程中起着关键作用[9-10]。研究表明,TNF-α与胰岛素抵抗密切相关[11-12],并通过减少外周组织脂肪分解,促进肝细胞甘油三酯合成与聚集,而引起脂质在肝组织异常蓄积[13-14]。TNF-α通过激活IKB激酶β(IKKβ)使Iκβ降解,从而活化N F-κB,NF-κB活化后即启动多种促炎因子基因,如TNF-α、IL-1、IL-6、IL-8、黏附因子、趋化因子等转录,这些细胞因子不仅可以直接诱导肝细胞炎症损伤,还趋化炎性细胞迁移,放大炎症反应,共同参与肝组织炎症、肝纤维化等病理生理过程[15-18]。除调控与炎症反应相关基因外,NF-κB还通过活化凋亡基因c-myc及凋亡相关因子Fas,引发Caspase家族Caspase-8及下游Caspase-3活化,形成级联反应导致肝细胞凋亡,并趋化中性粒细胞形成“瀑布式”炎症反应[20],反过来,炎症又能进一步活化肝细胞凋亡途径,形成恶性循环。
笔者前期研究以高脂饮食成功复制了NASH大鼠模型,丹参干预治疗后能改善NASH 大鼠肝功能及脂质代谢异常,减轻肝组织炎症。本实验结果表明模型组大鼠肝组织NF-κB表达增强,伴随TNF-α水平增高,提示NF-κB及TNF-α活性升高在NASH的发生发展中起关键作用,与既往研究一致[22],丹参干预治疗后大鼠脂质代谢紊乱改善,肝组织炎症减轻,NF-κB及TNF-α表达随着降低。综上,丹参干预能改善NASH 的炎症状态:一方面丹参通过抑制NF-κB的表达及活化,减少多种促炎因子基因转录,降低NASH 炎症相关因子TNF-α及其他炎性递质的释放,减轻氧化应激及细胞因子损伤;另一方面丹参可多方面调节脂代谢,减少肝脏脂质的沉积,改善肝功能及NASH 脂代谢紊乱,从而有效防治NASH 的发生发展。
热门论文
- 丹参对非酒精性脂肪性肝炎大鼠肝组织NF-/cB、
- 疏肝健脾方药对非酒精性脂肪性肝病大鼠肝细胞
- 消瘀化痰方对非酒精性脂肪肝大鼠肝细胞凋亡和
- 肝愈胶囊治疗非酒精性脂肪性肝炎的临床观察
- 肝愈胶囊治疗非酒精性脂肪性肝炎的临床观察
- 蠲脂汤治疗非酒精性脂肪肝63例疗效观察
- 非酒精性脂肪性肝病的诊断及治疗的研究发展
- 非肥胖2型糖尿病合并非酒精性脂肪性肝病危险因
- 非酒精性脂肪肝的中医药治疗方法的进展
- 肝病治疗仪联合复方丹参注射液治疗非酒精性脂
- 五田保肝液对酒精性肝病大鼠肝细胞凋亡的影响
- 柴胡温胆汤治疗非酒精性脂肪肝50例临床观察
- 非乙醇性脂肪肝患者血脂、血糖与肝功能检验结
- 肝胶囊对酒精中毒小鼠肝脏保护作用的组化
- 脂肪肝研究论文
